【Angew】黄维院士新发现:仅通过亲和力就能达到特定蛋白的识别
Monoamine Oxidase A
单胺氧化酶A
单胺氧化酶A(MAO-A)的异常表达与人类胶质瘤的病发密切相关,因此MAO-A被视为极具潜力的治疗靶点。鉴于此,快速准确地测定MAO-A对于疾病的诊断显得尤为至关重要。通过对双光子荧光团的筛选,作者发现一种名为N,N-二甲基萘胺(pre-mito)的衍生物,其可以高效地进入MAO-A的腔体入口。经过氨基丙基取代的CD1分子展现出了最快的MAO-A检测速度(仅需20秒)、更高的MAO-A亲和力以及较强的选择性。
初筛
为了快速检测 MAO-A,作者选择了六种具有深部组织成像能力的双光子荧光团,并通过分子对接对它们进行了筛选,最终确定了双光子荧光团(N,N-二甲基萘胺衍生物,pre-mito)。为了更好的与MAO-A结合,作者通过吡啶-N引入了三个不同的取代基,并且为探针赋予了线粒体靶向能力。
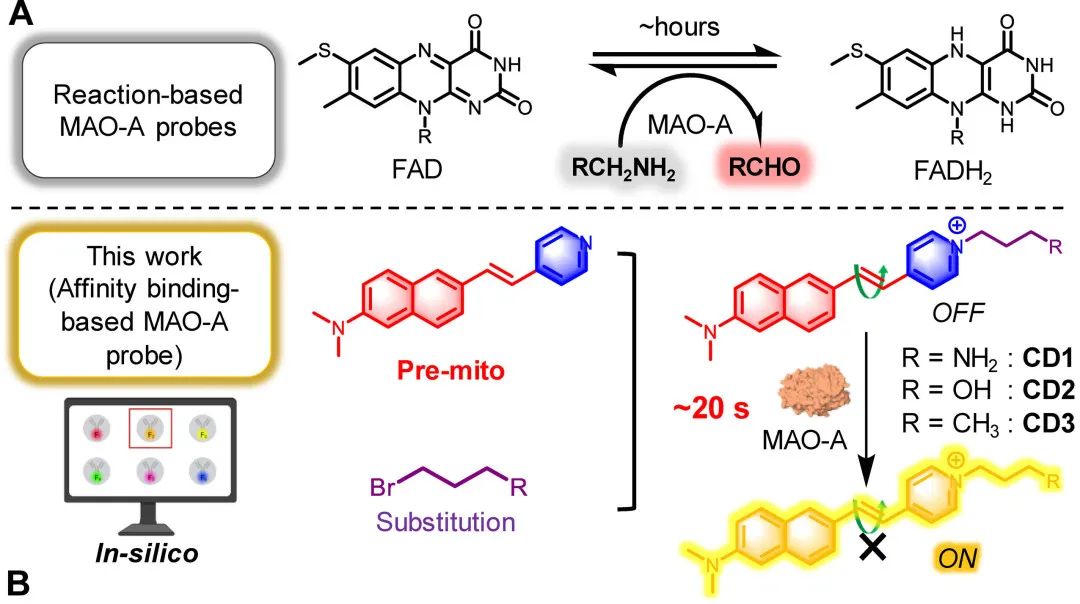 图 1.CD1-3的结构式
图 1.CD1-3的结构式
溶液测试
首先,作者利用分子对接法评估了 CD1-3 与 MAO-A 的结合亲和力。如图 2A 所示,与 MAO-B 相比,这三种探针都更倾向于进入 MAO-A 的空腔,其中 CD1 最接近 MAO-A 空腔的底部,其结合焓最低。此外,CD1的氨基丙基与MAO-A酶腔中的Asn181和Tyr191相互作用,促进了探针与酶腔的结合。而时间依赖性荧光分析也CD1 与 MAO-A 也证实了CD1具有最快的结合速度(图 2B),此外,加入 MAO-A 后,三种探针的荧光都显著增强,其中 CD1 的增强效果最好(图 2C)。CD1 对 MAO-A 也有很好的选择性,并且MAO-A抑制剂CL的存在并不会对其探测性能造成明显的影响(图2D) 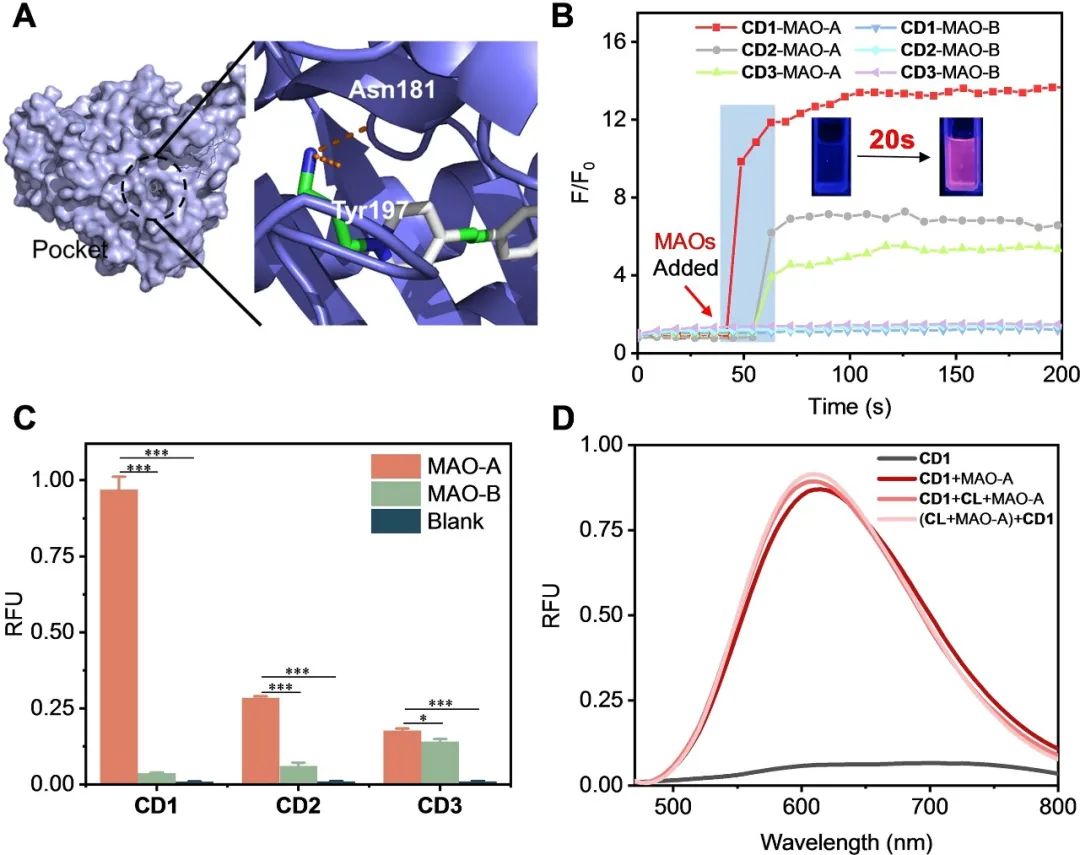 图2. A) CD1/MAO-A 的对接结果。B) CD1-3(2 μM)与 MAO-A 和 MAO-B(0.2 μM)在 PBS 缓冲液中孵育时的时间依赖性(0-200 秒)相对荧光变化曲线。C) 培养 1 分钟后,CD1-3(2 μM)在 MAO-A 或 MAO-B(0.2 μM)存在下的相对荧光强度。D)CD1 (2 μM)与 0.2 μM 的 MAO-A(CD1+MAO-A)、((CL+MAO-A)+CD1)或不(CD1+CL+MAO-A)与 MAO-A 预处理 30 分钟后的荧光光谱。
图2. A) CD1/MAO-A 的对接结果。B) CD1-3(2 μM)与 MAO-A 和 MAO-B(0.2 μM)在 PBS 缓冲液中孵育时的时间依赖性(0-200 秒)相对荧光变化曲线。C) 培养 1 分钟后,CD1-3(2 μM)在 MAO-A 或 MAO-B(0.2 μM)存在下的相对荧光强度。D)CD1 (2 μM)与 0.2 μM 的 MAO-A(CD1+MAO-A)、((CL+MAO-A)+CD1)或不(CD1+CL+MAO-A)与 MAO-A 预处理 30 分钟后的荧光光谱。
接着,作者进一步用 58 种常见干扰物对 CD1 进行了测试,包括阳离子、阴离子、氨基酸、蛋白质、核酸和酶,这些干扰物可能会引起荧光信号的干扰。结果表明,只有在 MAO-A 存在的情况下 CD1 的荧光信号才会增加,这证明了它对目标物的高选择性(图 3C)。随后在不同的温度和 pH 条件下评估了 CD1 对 MAO-A 的反应性,结果显示最佳反应条件为 37 °C 和 pH=7.4。这些结果表明 CD1 具有在生理条件下快速检测 MAO-A 的能力。鉴于 CD1 极佳的反应动力学和选择性,我们在将其应用于活细胞之前系统地探索了它的光物理特性。在有MAO-A存在的情况下,CD1的荧光量子产率(Φ)和双光子作用截面(δTF)都增加了,这表明CD1适用于生物组织中MAO-A的双光子荧光成像(图3D)。 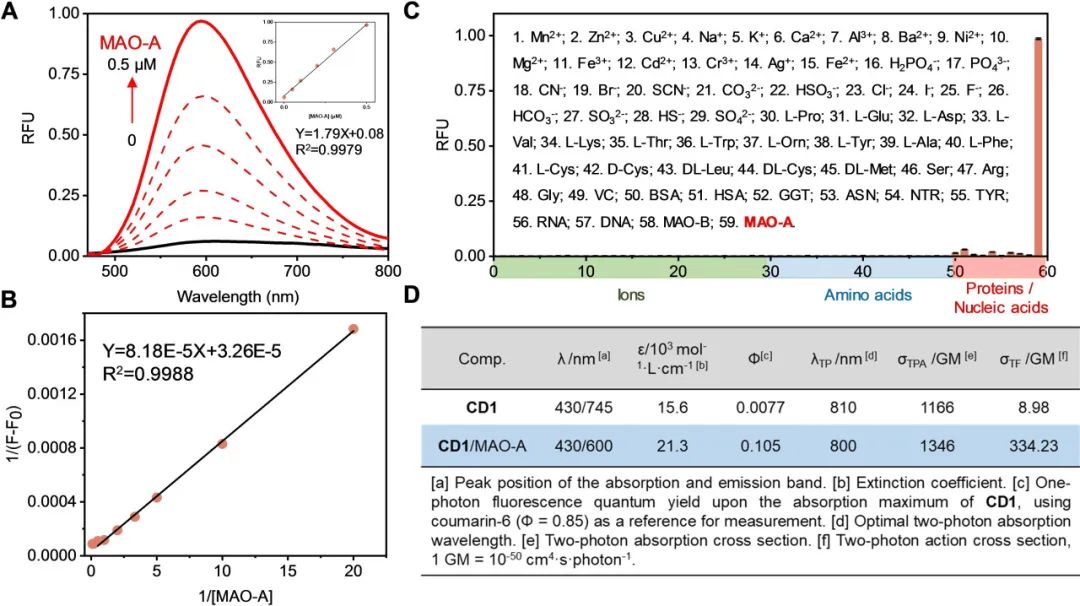 图3. A) CD1(0.5 μM)与不同浓度的 MAO-A(0-0.5 μM,1 分钟)孵育的荧光光谱。B)(A)的 Benesi-Hildebrand 拟合图。C) CD1(2 μM)在 PBS 缓冲液(pH=7.4)中不同分析物([1-49]:100 μM;[50-59]:1 μM)存在下的荧光特异性响应。D)CD1 和 CD1/MAO-A 在 PBS 缓冲液(pH=7.4)中的光物理性质。
图3. A) CD1(0.5 μM)与不同浓度的 MAO-A(0-0.5 μM,1 分钟)孵育的荧光光谱。B)(A)的 Benesi-Hildebrand 拟合图。C) CD1(2 μM)在 PBS 缓冲液(pH=7.4)中不同分析物([1-49]:100 μM;[50-59]:1 μM)存在下的荧光特异性响应。D)CD1 和 CD1/MAO-A 在 PBS 缓冲液(pH=7.4)中的光物理性质。
生物检测
受到上述结果的鼓舞,作者进一步研究了 CD1 在活细胞成像中的潜力,为了测试 CD1 在活细胞中对 MAO-A 的选择性,作者使用 CRISPR-Cas918 技术建立了内源性 MAO-A 基因敲除的 SH-SY5Y 细胞(SH-SY5Y MAO-A gRNA1)、非靶向对照(SH-SY5Y Ctrl gRNA)、转染 MAO-A 超表达慢病毒载体(POE)或空载体(Puro,辅助信息)的 HepG2 细胞。共焦成像显示 CD1 处理过的野生型 SH-SY5Y 细胞有清晰的荧光信号,而野生型 HepG2 细胞则没有。此外,CD1 处理的 SH-SY5Y MAO-A gRNA1 发出微弱的荧光,而 CD1 处理的 HepG2 MAO-A POE 则检测到强烈的荧光信号(图 4A&B)。每个细胞系中 MAO-A 的细胞水平都得到了 WB(图 4C)的进一步证实,证明 CD1 可以选择性地检测活细胞中的内源性 MAO-A。由于 MAO-A 位于线粒体外膜上,因此确认 CD1 的准确细胞定位非常重要,不出所料,共定位结果显示CD1的强红色荧光信号与MTG的绿色荧光信号很好地重叠(Person's r=0.76-0.86,图4A和B)。在活细胞实验成功的基础上,作者利用CD1和双光子荧光显微镜(TPFM)进一步探讨了临床胶质瘤和癌旁组织中MAO-A的检测。如图4D&E所示,CD1能有效地对深部肿瘤组织中的MAO-A进行成像,在CD1处理过的人胶质瘤组织中能检测到较强的荧光信号,而在CD1处理过的癌旁组织中荧光信号则明显较弱。这一观察结果与 WB 中相应的内源性 MAO-A 表达水平一致(图 4F)。随后,将 CD1 与相应的组织裂解液孵育 1 分钟,发现人胶质瘤组织裂解液中的荧光信号明显高于癌旁组织裂解液。这些结果表明 CD1 具有良好的组织成像能力,可用于快速检测胶质瘤中 MAO-A 的含量,并有可能区分肿瘤和癌旁组织。  图4. A) 活的 SH-SY5Y 细胞与 CD1(2 μM)孵育 1 小时后的单光子共聚焦荧光图像,B) CD1(2 μM)孵育 1 小时后活体 HepG2 细胞的单光子共聚焦荧光图像,C)(A 和 B)中图像的相对荧光强度。D) CD1 处理(10 μM,1 小时)的人胶质瘤(上)和癌旁组织(下)的内源性 MAO-A 含量的双光子荧光图像(左)和相应曲线图(右)。E) CD1 处理的人类胶质瘤(上图)和癌旁组织(下图)的荧光强度。F) (D)中重建组织图像的相对荧光强度曲线(红色)和插图中的相对 WB 信号(蓝色)。
图4. A) 活的 SH-SY5Y 细胞与 CD1(2 μM)孵育 1 小时后的单光子共聚焦荧光图像,B) CD1(2 μM)孵育 1 小时后活体 HepG2 细胞的单光子共聚焦荧光图像,C)(A 和 B)中图像的相对荧光强度。D) CD1 处理(10 μM,1 小时)的人胶质瘤(上)和癌旁组织(下)的内源性 MAO-A 含量的双光子荧光图像(左)和相应曲线图(右)。E) CD1 处理的人类胶质瘤(上图)和癌旁组织(下图)的荧光强度。F) (D)中重建组织图像的相对荧光强度曲线(红色)和插图中的相对 WB 信号(蓝色)。
结论
通过筛选和合理设计,作者成功地发现了一种用于快速检测 MAO-A 的基于亲和力结合的双光子荧光探针(CD1)。高选择性与 TICT 效应的结合造就了超快 MAO-A 荧光探针,可在 20 秒内完成检测,且特异性高、检测限低。活细胞和组织成像实验表明,CD1 可以选择性地检测复杂生理环境中线粒体上的内源性 MAO-A 含量。虽然 CD1 不能反映 MAO-A 酶的活性,但其独特的反应机制可在超短时间内快速报告 MAO-A 的水平。这种特性使 CD1 成为一种潜在的分子工具,可在快速临床诊断和术中图像引导中快速筛查 MAO-A 水平。
参考文献
Zhang, C.; Fang, H.; Du, W.; Zhang, D.; Qu, Y.; Tang, F.; Ding, A.; Huang, K.; Peng, B.; Li, L.; Huang, W. Ultrafast Detection of Monoamine Oxidase A in Live Cells and Clinical Glioma Tissues Using an Affinity Binding‐Based Two‐Photon Fluorogenic Probe. Angew Chem Int Ed 2023, e202310134. https://doi.org/10.1002/anie.202310134.